|
豬瘟病毒抗體定量檢測試劑盒豬瘟病毒的流行病學特點 本病在自然情況下只感染豬,對不同性別、年齡、品種的家豬和野豬均有易感性。但免疫母豬所生仔豬30天后易感染性增強。斷奶后15-60天多發,病程7-20天周達流行高峰。病豬是主要傳染源。病毒通過糞便、尿液及其他分泌物排出體外,污染飼料,飲水及周圍環境等,經消化道而感染。本病的發生沒有季節性,新疫區呈急性暴發,發病率和死亡率都高。老疫區,豬群有一定的免疫力,長期呈慢性流行,如有細菌繼發感染則病情加重。近些年來在豬群中出現一種非典型豬瘟,或稱溫和型豬瘟,癥狀輕微,病變不典型,病死率達30%~50%。 防控措施    1、傳染源的阻斷 把關好引種步驟,加強外來豬的檢疫工作。 2、免疫過程的嚴格落實 嚴格把握好引進疫苗的質量,選擇免疫效果優良的疫苗。 3、免疫監測 建立完善的定期免疫監測機制,根據監測的結果科學合理的免疫,避免低質量疫苗,以及豬繁殖與呼吸綜合征疾病導致的免疫失敗的產生,同時也可用以檢查緊急免疫的效果,避免重復接種
豬瘟病毒抗體水平監測意義 仔豬豬瘟母源抗體是未進行豬瘟超前免疫的初生仔豬獲得保護力的重要因素,其主要從初乳中獲得。母源抗體的存在,可使仔豬在一定時間內被動地得到保護,但又給免疫接種帶來影響。由于母源抗體對疫苗有中和、清除等作用,所以,若初免過早,會因母源抗體水平高,對疫苗產生中和作用導致免疫失敗;而如果初免時間過遲,又會因仔豬母源抗體水平過低而易受環境中豬瘟病毒的侵襲。因此了解豬瘟抗體動態水平是防治該病的關鍵。 豬瘟抗體水平檢測的主要方法主要包括病毒分離鑒定、分子生物學及血清學方法。 血清學抗體檢測方法操作簡單、高通量、價格低廉 中和試驗操作復雜、檢測周期較長、對試驗儀器與操作人員技術水平要求均較高,很難在基層推廣應用; 間接血凝試驗(IHA)是我國豬瘟抗體檢測的經典方法,在國內得到了廣泛應用,但該方法敏感性低,待測血清樣品需經滅活處理,增加了檢測時間和檢測難度,且血清的質量嚴重影響檢測結果,誤差較大,不適合準確檢測豬瘟抗體水平。 間接ELISA與阻斷ELISA具有微量、敏感、特異、高通量的優點,可用于豬瘟抗體水平監測,但其需要酶標儀等儀器設備,且操作人員需有一定的專業技術水平,適合具有基本試驗條件的基層實驗室; 斑點 ELISA(Dot-ELISA)與膠體金免疫方法無需特殊儀器設備、操作簡便、檢測時間短,但檢測結果無法定量,不能動態的監測群體抗體水平。 RT-PCR檢測方法的敏感性高,在許多實驗室這兩種方法已經成為常規的檢測CSFV的方法。RT-PCR檢測方法盡管敏感快速,但操作不當容易出現假陽性和假陰性的結果。具有檢出率高、準確性好的優點,檢測時間也較短(4-6h)。 高敏熒光免疫層析法,該方法借鑒膠體金的原理,以標記了熒光微球的抗原(抗體)與樣本中抗體(抗原結合),再與硝酸纖維素膜上的抗原(抗體)結合,用特定機器測試熒光強度,從而實現定量,該方法具有膠體金的快速,Elisa的準確率,與Idexx符合率在90%以上,是一種非常有發展前景的檢測方法。  檢測原理  Wellray®豬瘟病毒抗體定量檢測試劑盒以雙抗原夾心法為基礎,采用微瑞高敏熒光層析技術快速定量測定樣本中豬瘟病毒抗體的含量。充分層析后的檢測卡經WellRay®WR-1608熒光儀檢測,通過預置的標準曲線自動計算出樣本中豬瘟病毒抗體的含量。 定量檢測抗體水平阻斷率評估值(0~*),檢測結果大于40%(含)時抗體保護水平為陽性,小于40%時抗體保護水平為陰性; 定量檢測抗體中和抗體效價(1~10000效價):當樣本檢測結果,效價大于32(含)時抗體有保護,小于32時抗體不保護,檢測效價與豬瘟抗體含量成正比。
1 對血清中的豬瘟病毒抗體進行快速準確定量檢測。 2 高低端中和抗體濃度均可準確定量。 3 與Idexx阻斷率比對結果符合率在90%以上。
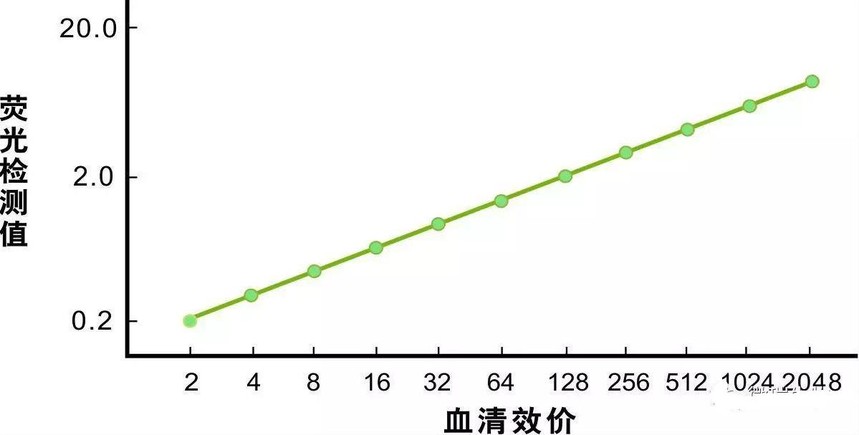
試劑盒將被檢血清滴加入高敏納米熒光層析試紙條,通過免疫層析15分鐘后,用熒光儀檢測T線和C線的熒光信號,通過軟件將T/C值代入內置的標準曲線,軟件自動計算檢測得出具體的豬瘟抗體效價。該效價值代表了用陰性血清對半稀釋陽性血清至抗體效價下降至50%抗體保護時所需的稀釋倍數。對于這種評價方式,成都微瑞給出的參考陰陽性臨界點為1:32,50對應的是IDEXX試劑盒30%的阻斷率,檢測結果32以下為陰性,32以上為陽性。 
|





 冀ICP備2021013042號-1
冀ICP備2021013042號-1